百济神州2021年亏损97.48亿同比亏损减少 新增技术授权和研发服务收入
挖贝网2月25日,百济神州(688235)发布2021年度业绩快报公告,公告显示,2021年1-12月营业总收入为7,588,957千元,比上年同期增长257.9%;归属于母公司股东的净利润为-9,747,673千元,较上年同期亏损减少。
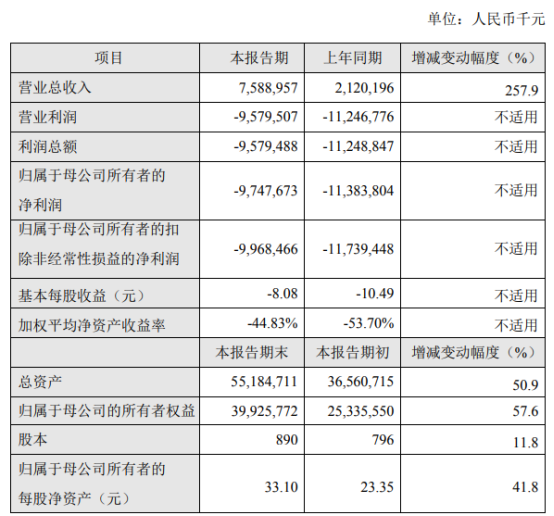
公告显示,百济神州总资产为55,184,711千元,比本报告期初增长50.9%;基本每股收益为-8.08元,上年同期为-10.49元。
报告期内,公司营业收入75.89亿元,较上年同比增长257.9%;归属于母公司所有者的净利润-97.48亿元。报告期末,公司总资产551.85亿元,较期初增长50.9%;归属于母公司的所有者权益399.26亿元,较期初增长57.6%。
2021年,产品收入为40.90亿元,上年同期产品收入为21.20亿元,产品收入的增长主要得益于自主研发产品和授权产品的销售增长。合作收入为34.99亿元,主要来自于对与Novartis Pharma AG(以下简称“诺华制药”)分别于2021年第一季度就PD1抗体药物百泽安®获得的6.5亿美元合作预付款和2021年第四季度就TIGIT抑制剂ociperlimab的3亿美元合作预付款进行的部分收入确认。
2021年,BTK抑制剂百悦泽®(泽布替尼胶囊)全球销售额总计14.06亿元,上年同期全球销售额总计2.86亿元。其中,美国市场销售额总计7.46亿元,上年同期美国市场销售额总计1.26亿元,主要来自在套细胞淋巴瘤(MCL)、华氏巨球蛋白血症(WM)和边缘区淋巴瘤(MZL)领域持续增加的市场需求使得2021年在美销售增长继续加速。在中国,百悦泽®销售额总计6.52亿元,上年同期中国市场销售额总计1.60亿元,中国市场销售额的增长主要得益于在包括慢性淋巴细胞白血病(CLL)、MCL和WM等多个已获批适应症领域的销售增长。百悦泽®新增用于治疗既往至少接受过一种治疗的成人的WM患者的一项适应症已获纳入国家医保目录(2021年)。
2021年,百泽安®(替雷利珠单抗注射液)在中国的销售额总计16.47亿元,上年同期中国市场销售额总计11.18亿元。医保报销范围扩大带来的新增患者需求、进一步扩大的销售团队以及药品进院数量增加,持续推动了百泽安®市场渗透率和市场份额的扩大。百泽安®新增一线治疗非鳞状非小细胞肺癌(NSCLC)、一线治疗鳞状NSCLC和二线或三线治疗肝细胞癌(HCC)三项适应症获纳入国家医保目录(2021年)。
2021年,中国商业化团队持续发力,不断将新产品带到市场。2021年新上市自主研发产品百汇泽®(帕米帕利胶囊),针对治疗既往接受过二线及以上化疗的伴有胚系BRCA(gBRCA)突变的复发性晚期卵巢癌、输卵管癌或原发性腹膜癌患者。百汇泽®已获纳入国家医保目录(2021年)。国家医保目录(2021年)已于2022年1月1日起正式执行。2021年新上市的授权产品包括倍利妥®(注射用贝林妥欧单抗)、凯泽百®(达妥昔单抗β注射液)、萨温珂®(注射用司妥昔单抗)与普贝希®(贝伐珠单抗注射液生物类似药)。目前公司在中国商业化共11款产品,其中8款为授权产品。
公司致力于做中国创新药出海的先行者,持续推进自主研发药物的全球化进展,提高药物可及性。百悦泽®广泛的全球临床布局包括在超过25个国家开展了30多项临床试验,入组受试者超过4,000人,其中超过3,000人来自海外入组。公司近期公布百悦泽®用于治疗成人慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者的新适应症上市许可申请获得美国食品药品监督管理局(以下简称“FDA”)受理。根据处方药申报者付费法案(PDUFA),FDA做出决议的目标日期为2022年10月22日。百悦泽®用于治疗CLL和MZL患者的两项新适应症的上市许可申请也获得欧洲药品管理局(EMA)受理。百悦泽®目前已在包括美国、中国、欧盟(27个成员国及冰岛、列支敦斯登和挪威)、英国、加拿大、澳大利亚、瑞士、沙特阿拉伯、厄瓜多尔、以色列、韩国等全球45个国家和地区获批,另有针对多种适应症的40余项新药上市申请正处于药政审评中。百泽安®广泛的全球临床布局包括在超过35个国家和地区开展了50项临床试验,入组受试者超过9,000人,其中近3,000人来自海外入组。在美国,针对治疗二线鳞状食管癌(ESCC)的新药上市申请已获FDA受理,根据处方药申报者付费法案(PDUFA),FDA做出决议的目标日期为2022年7月12日。此外,公司将继续为合作伙伴诺华制药就计划于今年提交的百悦泽®新适应症上市申请提供支持,包括在美国提交针对一线鼻咽癌(NPC)和肺癌以及在欧洲提交针对肺癌的新药上市申请。与此同时,公司也在大力推进早期管线产品的全球临床布局和进展,目前TIGIT抑制剂ociperlimab的临床布局包括两项分别针对一线PD-L1高表达非小细胞肺癌患者和初治局部进展无法切除的非小细胞肺癌患者的全球临床三期,四项全球临床二期覆盖非小细胞肺癌、小细胞肺癌、宫颈癌、食管癌等适应症。公司计划将在今年就ociperlimab启动更多的关键性临床试验,并继续推进其他管线产品包括BCL2抑制剂BGB-11417,OX-40抗体BGB-A445和HPK1抑制剂BGB-15025等药物候选物的临床进展。
此外,公司通过加强自主研发能力和合作,加速推进多元、创新的药物管线开发。公司于2021年1月宣布与诺华制药达成合作,将在北美、日本、欧盟及其他六个欧洲国家开发和商业化抗PD-1抗体百泽安®。公司获得6.5亿美元预付款并有资格获得至多15.5亿美元的潜在注册和销售里程碑付款,以及产品销售特许使用费。2021年12月,公司扩大与诺华制药的合作,签订选择权、合作和许可协议。根据该协议,公司向诺华制药授予一项独家的、基于时间的选择权,以使诺华制药可以通过行使该选择权获得在北美、日本、欧盟及其他六个欧洲国家对公司的在研TIGIT抑制剂ociperlimab进行开发、生产和商业化的独家许可。公司从诺华制药获得3亿美元的现金预付款。此外,如诺华制药于2023年年中前或年中到2023年年底期间行使选择权,则公司有资格获得6亿或7亿美元的额外付款。该协议下的许可需根据适用的法律规定完成所需要的相关反垄断审批。此外,如诺华制药行使选择权,公司有资格获得至多7.45亿美元的药政里程碑付款、11.5亿美元的销售里程碑付款,以及有资格基于ociperlimab在许可地区的年度净销售额获得分级许可使用费。公司还有权在中国广阔市场营销和推广北京诺华制药有限公司5款已获批且已纳入国家医保药品目录的抗肿瘤药物,包括泰菲乐®(达拉非尼)、迈吉宁®(曲美替尼)、维全特®(帕唑帕尼)、飞尼妥®(依维莫司)以及赞可达®(塞瑞替尼)。
受上述产品收入和合作收入增长的影响,公司2021年度亏损总额较上年同期有所下降。
报告期内,公司营业收入较上年同期增长257.9%,主要系公司自研产品和授权产品的销量增加,以及新增技术授权和研发服务收入所致。
报告期内公司总资产、归属于母公司的所有者权益、归属于母公司所有者的每股净资产较去年同期分别增长50.9%、57.6%、41.8%,主要系报告期内公司在科创板首次公开发行股票募集资金到账所致。
相关阅读
- 西安奕材IPO:聘请中国政法大学现任院长商文江担任独董 研发人员平均薪酬或达61万接近沪硅产业3倍
- 恒坤新材:在“材料突围战”中崛起的中国样本
- 博瑞医药拟向实控人袁建栋定增5亿元:按照目前股价计算 一旦实施袁建栋将浮盈15亿元
- 科捷智能拟续聘毕马威华振为审计机构:审计费用135 万元
- 毕得医药续聘中汇为审计机构:质量控制复核人杨建平曾购买审计客户股票受到行政监管措施
- 未来材料IPO:去年净利润下滑近30%核心产品毛利率下滑15个百分点 品质难以稳定退换货比例走高
- 优迅股份IPO:毛利率持续下滑 销售费用率、存货跌价计提比例不及可比公司均值一半
- 钶锐锶科创板IPO:毛利率逆势上升比可比公司均值高出近20个百分点 最新估值18亿元较前次下滑8%
- 电科蓝天科创板IPO:应收账款规模近乎2年翻倍,1年以上应收账款近10亿元,关联销售占比超过50%
- 信宇人更正2024年半年报等三份业绩报告:原亏损3287万元 更正后亏损4341万元
推荐阅读
快讯 更多
- 07-09 13:16 | 三重焕新,启航未来——Pivotal中文品牌发布暨乔迁新址、新官网上线
- 04-10 11:21 | 为“首发经济”注入创新动力,CMEF见证宽腾医学影像技术革新
- 02-20 18:53 | 手机也要上HBM芯片?三星计划推出移动版HBM,预计首款产品2028年上市
- 12-30 16:40 | 国产首款DDR5内存问世!价格战开启,复制长江存储击败三星路径!
- 12-30 16:36 | 华为手机回归第一年:全年销量或超4000万台 有望凭借Mate 70在高端市场击败苹果
- 11-26 18:19 | 众兴菌业拟与涟水县人民政府签订《招商引资合同书》 拟投资设立涟水食用菌产业园项目
- 11-26 18:16 | 美芝股份中选vivo全球AI研发中心-精装工程采购项目(标段二)
- 11-26 18:14 | 健之佳拟用不超1亿回购公司股份 维护公司价值及股东权益
- 11-26 09:53 | 格灵深瞳收购深圳市国科亿道科技有限公司部分股权并增资5000万
- 11-26 09:37 | 炜冈科技拟以1.49亿购买衡所华威9.33%股权 华海诚科拟发行可转债收购炜冈科技所持衡所华威股权




